药械办事指南 | 第一类医疗器械产品首次备案
一、基础信息
1.1事项名称:第一类医疗器械产品首次备案
1.2事项类型:其他行政权力
1.3实施主体:当地市/区市场监督管理局
1.4实施主体性质:法定机关
1.5服务对象:企业法人
1.6受理条件:
按照《第一类医疗器械产品目录》《体外诊断试剂分类子目录》和有关分类界定结果等判定为第一类医疗器械的,备案人向相应的备案部门办理备案。
二、设计依据
2.1关联法规:
2.1.1《医疗器械监督管理条例》:第一类医疗器械实行产品备案管理。第一类医疗器械产品备案,由备案人向所在地设区的市级人民政府负责药品监督管理的部门提交备案资料。
2.1.2《医疗器械注册与备案管理办法》:设区的市级负责药品监督管理的部门负责境内第一类医疗器械产品备案管理工作。第一类医疗器械实行产品备案管理,境内第一类医疗器械备案,备案人向设区的市级负责药品监督管理的部门提交备案资料。
2.1.3《体外诊断试剂注册与备案管理办法》:设区的市级负责药品监督管理的部门负责境内第一类体外诊断试剂产品备案管理工作。第一类体外诊断试剂实行产品备案管理,境内第一类体外诊断试剂备案,备案人向设区的市级负责药品监督管理的部门提交备案资料。
三、申报流程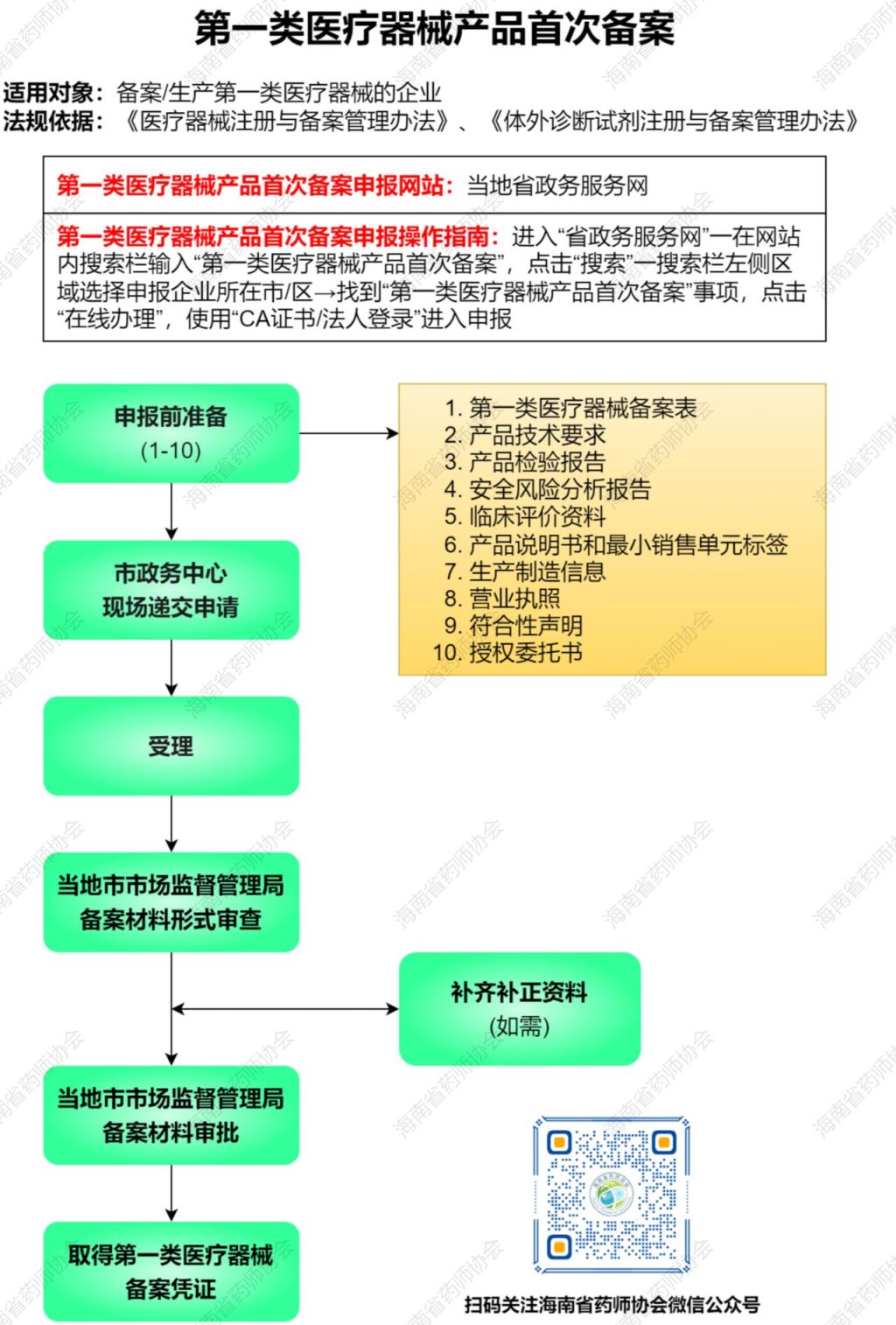
四、样例
