药械办事指南 | 进口第一类医疗器械备案
一、基础信息
事项名称:进口第一类医疗器械备案
事项类型:公共服务
实施主体:国家药品监督管理局
实施主体性质:法定机关
服务对象:营利法人
受理条件:境外备案人指定的中国境内企业法人。
二、设计依据
关联法规:
1.《医疗器械监督管理条例》: 向我国境内出口第一类医疗器械的境外备案人,由其指定的我国境内企业法人向国务院药品监督管理部门提交备案资料和备案人所在国(地区)主管部门准许该医疗器械上市销售的证明文件。未在境外上市的创新医疗器械,可以不提交备案人所在国(地区)主管部门准许该医疗器械上市销售的证明文件.
2.《医疗器械注册与备案管理办法》: 境外申请人、备案人应当指定中国境内的企业法人作为代理人,办理相关医疗器械注册、备案事项。代理人应当依法协助注册人、备案人履行《医疗器械监督管理条例》第二十条第一款规定的义务,并协助境外注册人、备案人落实相应法律责任.
3.《体外诊断试剂注册与备案管理办法》: 境外申请人、备案人应当指定中国境内的企业法人作为代理人,办理相关体外诊断试剂注册、备案事项。代理人应当依法协助注册人、备案人履行《医疗器械监督管理条例》第二十条第一款规定的义务,并协助境外注册人、备案人落实相应法律责任.
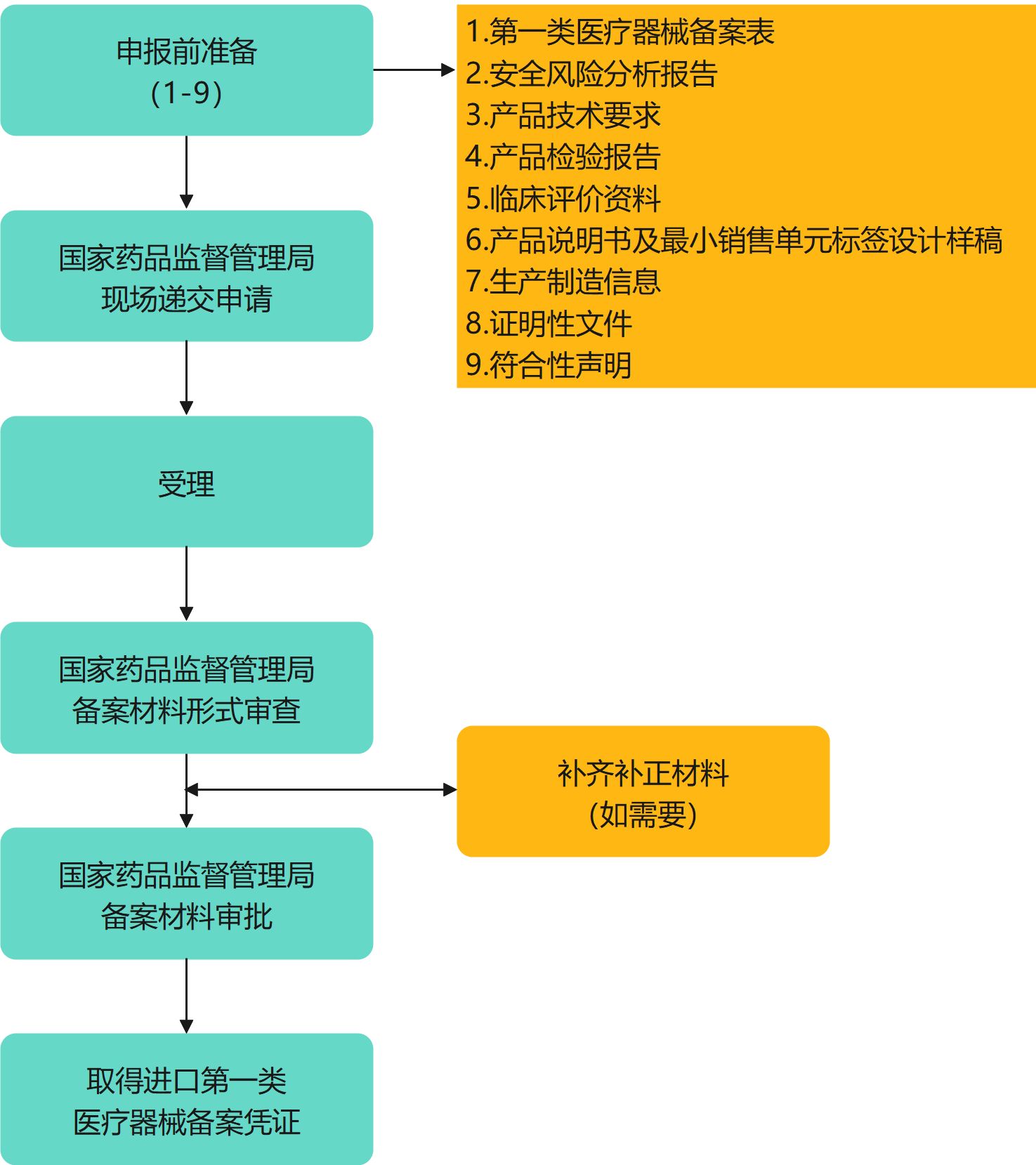
三、申报流程
进口第一类医疗器械备案
适用对象:境外备案人指定的中国境内企业法人
法规依据:《医疗器械监督管理条例》、《医疗器械注册与备案管理办法》、《体外诊断试剂注册与备案管理办法》
进口第一类医疗器械备案申报网址:
https://zwfw.nmpa.gov.cn
进口第一类医疗器械备案申报操作指南:
进入“国家药品监督管理局政务服务门户”→网站内搜索“进口第一类医疗器械备案”→点击“在线办理”,使用“CA证书/法人登录”进入申报。
申报要求:
CA证书/法人登录,上传电子版材料申报,每个文件应不大于20Mb。
注意事项:
1. 申请进口医疗器械注册、办理进口医疗器械备案,应当提交申请人、备案人注册地或者生产地所在国家(地区)主管部门准许该医疗器械上市销售的证明文件。
2. 申请人、备案人注册地或者生产地所在国家(地区)未将该产品作为医疗器械管理的,申请人、备案人需提供相关文件,包括注册地或者生产地所在国家(地区)准许该产品上市销售的证明文件。
3. 未在申请人、备案人注册地或者生产地所在国家(地区)上市的创新医疗器械,不需提交相关文件。
四、样例
